作者:Ewen Callaway
《自然》杂志,第531卷,557–558页(2016年)
Craig Venter的创作正值CRISPR基因编辑方法为改造生命的基本构件提供了替代途径。

合成生物学家Craig Venter,他的团队在二十年前开始了精简生命至其基本要素的探索之旅。
(图片来源:Michael Lewis/Corbis Outline)
基因组企业家Craig Venter创造了一个合成细胞,包含任何已知独立生物中最小的基因组。这个具有473个基因的细胞是他团队20年来努力将生命简化到基本要素并由此从头设计生命的一个里程碑。
Venter共同创立了一家公司,致力于利用合成细胞制造工业产品,他表示这一成就预示着可定制细胞的诞生,用于制造药物、燃料和其他产品。但基因组编辑技术的爆炸性发展——特别是使基因组的选择性改造变得相对容易的CRISPR-Cas9工具——引发了一个令人困扰的问题:当你可以简单地修改现有生物时,为什么还要费力去创造新的生命形式?
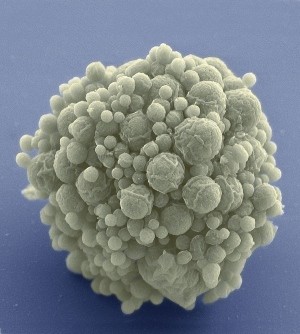
JCVI-syn3.0的每个细胞仅包含473个基因,少于任何其他独立生物。
(图片来源:Thomas Deerinck and Mark Ellisman/NCMIR/UCSD)
与2010年制造的第一个合成细胞不同,当时Venter在加利福尼亚州拉霍亚的J. Craig Venter研究所的团队复制了一个现有的细菌基因组并将其移植到另一个细胞中,这次的最小细胞的基因组在自然界中并不存在。Venter表示,这个细胞(在3月24日发表于《科学》杂志的一篇论文中被描述)构成了一个全新的人工物种。
“构建完整基因组的理念是合成生物学的梦想和承诺之一,”未参与该工作的伦敦帝国理工学院合成生物学家Paul Freemont说。
从头设计和合成基因组仍然是一个小众追求,技术要求高。相比之下,基因组编辑的使用正在飙升——其最著名的工具CRISPR-Cas9已经在工业、农业和医学领域获得了认可。哈佛医学院的基因组科学家George Church(使用CRISPR)指出:“CRISPR的应用无需太多努力就出现了,突然之间就有3万人在使用CRISPR,可能更多。”
当Venter的团队开始努力将生命精简到基本要素时,微生物学家们才刚刚开始描述科学家们最终会借鉴并命名为CRISPR的细菌免疫系统。在1995年的一篇《科学》论文中,Venter的团队测序了支原体生殖器菌(Mycoplasma genitalium)的基因组,这是一种已知的基因组最小的自由生活微生物,并绘制了其470个基因。通过逐一失活基因并测试细菌是否仍能存活,该团队将必需基因列表缩减至375个。
验证这一假设的方法之一是制造一个仅包含这些基因的生物体。因此,Venter与其密切合作的Clyde Hutchison和Hamilton Smith以及他们的团队,开始从头开始构建一个最小基因组,方法是连接合成的DNA片段。此过程需要开发新技术,但到2008年,他们已经使用该方法制造了实际上与支原体生殖器菌基因组完全相同的基因组,还包括数十个不起作用的DNA“水印”。
但天然支原体生殖器菌细胞的缓慢生长促使他们转向繁殖更快的支原体螺旋菌(Mycoplasma mycoides)。这次,他们不仅合成了其基因组并用他们的名字和名言等水印标记,还将其植入了已清空自身基因组的另一个细菌中。
由此产生的“JCVI-syn1.0”细胞在2010年首次亮相,被誉为——尽管许多人认为是夸张的——合成生命的黎明。(这一壮举促使美国总统奥巴马发起了生物伦理审查,梵蒂冈也质疑Venter声称他创造了生命。)然而,该生物体的基因组是通过复制现有的蓝图而非设计构建的,其超过100万个碱基的庞大基因组也远非最小。
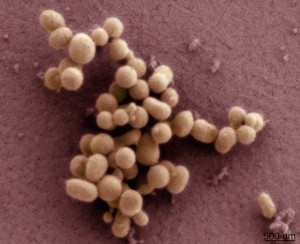
JCVI-syn1.0细胞在2010年被誉为合成生命的黎明。
(图片来源:Thomas Deerinck and Mark Ellisman/NCMIR/UCSD)
为了完成其长期以来设计最小基因组的目标,Venter的团队设计并合成了一个含有483,000个碱基、471个基因的支原体螺旋菌染色体,从中删除了负责生产可外部提供的营养物质的基因和其他遗传“浮渣”。但这并未产生可存活的生物体。
因此,进一步的举措是,团队开发了一个“设计-构建-测试”循环。他们将支原体螺旋菌基因组分成八个DNA片段,并混合搭配以观察哪些组合能够产生可存活的细胞;从每个循环中学到的经验教训指导了下一次设计中包含哪些基因。这个过程突出了不编码蛋白质但仍然必需的DNA序列,因为它们指导着必需基因的表达,以及执行相同必需任务的基因对——当此类基因逐一删除时,都被错误地认为是可有可无的。
最终,团队找到了被称为JCVI-syn3.0的531,000个碱基、473个基因的设计方案(syn2.0是一个较少优化的中间产物)。Syn3.0的倍增时间为3小时,相比之下,支原体螺旋菌为1小时,支原体生殖器菌为18小时。
“诺贝尔物理学家理查德·费曼曾说过,‘我不能创造的东西,我就无法理解’,这个原则现在得到了体现,”瑞士苏黎世联邦理工学院的合成生物学家Martin Fussenegger说。“你可以添加基因,看看会发生什么。”
由于几乎所有的营养物质都通过生长培养基提供,syn3.0的必需基因往往是那些参与蛋白质制造、DNA复制和细胞膜构建等细胞任务的基因。令人惊讶的是,Venter表示,他的团队无法确定syn3.0基因组中149个基因的功能,其中许多在其他生物体(包括人类)中也存在。“我们对大约三分之一的生命必需部分一无所知,我们现在正努力弄清楚这一点,”他说。
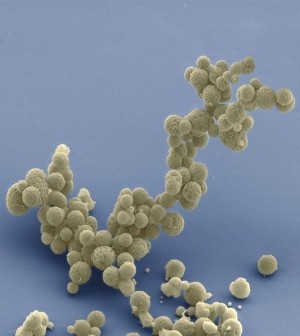
Syn3.0细胞每3小时倍增一次。
(图片来源:Thomas Deerinck and Mark Ellisman/NCMIR/UCSD)
这令Fussenegger感到震惊。“我们已经测序了地球上的所有东西,但我们仍然不知道149个最重要的生命必需基因!”他说。“这是我最想知道的酷事。”
Syn3.0对合成生物学的持久影响是一个悬而未决的问题。Church说:“我认为这有点像乔治·马洛里的时刻,”他指的是1924年在尝试成为第一个登上珠穆朗玛峰的人时遇难的英国登山家。“‘因为山在那里’,这是他攀登珠峰的理由。”
Church表示,基因组编辑技术将仍然是大多数需要少量基因改造的应用的首选,而基因组设计将用于特殊应用,例如重新编码整个基因组以纳入新的氨基酸。Fussenegger认为,基因组编辑将是治疗的首选方法,但从头合成基因组将吸引对基因组如何进化等基本问题感兴趣的科学家。
即使Venter也承认,尽管syn3.0的基因组是新的,但它是通过试错而非基于对如何构建功能基因组的基本理解而设计的。但他预计会有快速的改进,并认为从头合成基因组将成为操纵生命的首选方法。“如果你想做一些小的改动,CRISPR是一个很好的工具,”他说。“但如果你真的想创造新的东西,想设计生命,CRISPR无法满足你的需求。”